北理工課題組在功能化外泌體抗腫瘤研究方面取得重要進展

近日,國際著名期刊Advanced Science (IF=""16.806)"" 報道了意昂3官网黃淵余課題組在功能化外泌體抗腫瘤治療方面的研究進展,相關意昂3平台以“Conscription of Immune Cells by Light-Activatable Silencing NK-Derived Exosome (LASNEO) for Synergetic Tumor Eradication”為題在線發表。該工作第一作者為意昂3官网生命學院/前沿交叉科學研究院博士研究生張萌潔👨🏻🎤,通訊作者為意昂3官网黃淵余教授🤚🏻。
自然殺傷(Natural Killer, NK)細胞是機體重要的免疫細胞🏊🏼♂️🤾🏿♂️,其作為先天免疫的重要組成部分在腫瘤治療中具有重要的應用🧑🏽🌾。NK細胞來源的外泌體(NK-derived Exosome, NEO)一定程度地“遺傳”了NK細胞的免疫調節功能👱♂️,外泌體的直徑約為30–120 nm(NK細胞的直徑約為10 µm),其在腫瘤組織具有更好的滲透能力,因而NEO是具有良好應用前景和潛力的抗腫瘤生物製劑🤐。然而🫄,NEO自身的抗腫瘤效應不夠強,如何顯著提高NEO的免疫調節能力或賦予其多機製協同的抗腫瘤能力,是實現臨床有效治療的關鍵問題👩🏼✈️。
基於此,黃淵余團隊通過電穿孔將親水性小幹擾核酸(siRNA)裝載到NEO內部😨,並將疏水性光敏劑小分子Ce6負載到NEO膜上,構建了一種“可光激活的沉默性NK外泌體(Light-activatable silencing NK-derived exosomes, LASNEO)”體系🧖。該納米體系進入細胞後,可以在660nm光照條件下產生活性氧(ROS)🔮,實現光動力治療的同時🕵️♂️,促進siRNA入胞並釋放到細胞質中🦑,提高其基因沉默效果⛷;同時ROS還可促進巨噬細胞向M1型轉變🧝,促進DC細胞成熟🤴🏽,進一步提高小鼠體內的抗腫瘤免疫應答✊🏻▫️;當siRNA選擇靶向PD-L1的siRNA時,抑製腫瘤細胞的PD-L1基因表達,可重建T細胞的免疫監視和殺傷能力。因此,LASNEO體系具有調節多種免疫細胞的能力,通過多機製協同的策略實現抗腫瘤治療(圖1)。
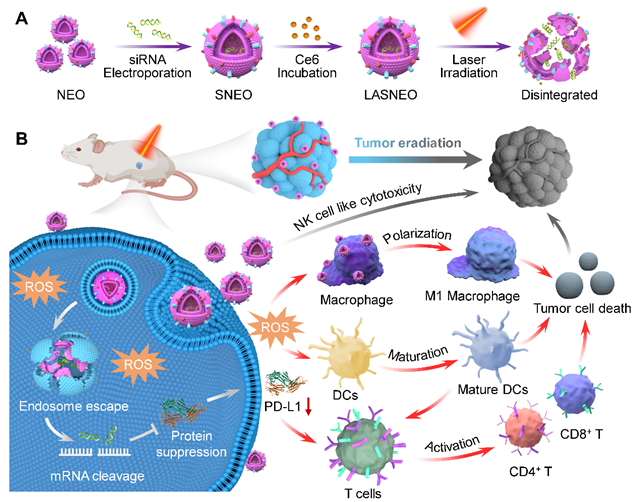
圖1 LASNEO製備過程及其抗腫瘤機製示意圖
首先🧝🏿,研究人員用NEO處理腫瘤細胞🧑🏽🚒,通過RNA-seq技術對腫瘤細胞中上調和下調的基因進行分析,同時結合Western Blot等生化實驗⚛️,證明經過NEO處理後🏫,腫瘤細胞的凋亡通路基因顯著變化,證明了NEO可以促發“類NK細胞”的殺傷效應🫦。隨後🍁,研究人員在細胞水平上驗證了LASNEO的入胞能力和機製,以及ROS生成情況😯、細胞凋亡作用等。接著,研究人員用LASNEO負載拮抗PLK1基因的siRNA(siPLK1)在荷瘤小鼠模型上開展了實驗◾️,證實LASNEO擁有良好的抗腫瘤作用👩🏻🦼➡️。最後,通過負載拮抗PD-L1的siRNA(siPD-L1)🛌🏻,LASNEO下調了小鼠腫瘤細胞中PD-L1的表達👨🏻🔬,流式細胞術的結果顯示光照的LASNEO引起了CD8+ T細胞的升高,提高了M1型巨噬細胞的比例🤱🏿,同時促進了DC細胞的成熟,這表明LASNEO成功重塑了腫瘤組織的免疫微環境,調動了多類免疫細胞,通過多種機製的協同實現了有效的抗腫瘤治療。同時,LASNEO還具備良好的穩定性和安全性,其製備過程也簡單可控。上述研究意昂3平台已提交專利申請。
附作者簡介👨👦👦:
黃淵余,意昂3官网教授🎉、博士生導師;入選國家級青年人才👩🏼🏫💽、北京市科技新星👨🏻🔧。研究內容主要圍繞核酸技術與藥物/疫苗展開。以通訊/第一作者在Sci Adv、Signal Transduct Target Ther等發表論文約60篇👧,IF>10論文近30篇;共發表論文約90篇👺,撰寫10余部專著章節,申請16件專利🏑。曾獲得中美納米醫學與納米生物技術學會“未來之星”獎(2019)等榮譽👩🏿🔧;是中國生物物理學會納米生物學分會秘書長,另多個學會理事或委員🍧👶🏽;是Exploration副主編(Wiley出版)、Chinese Chemical Letters👷🏽♀️、生物化學與生物物理進展等多個期刊(青年)編委🤦♀️。
課題組主頁: https://www.x-mol.com/groups/Yuanyu_Huang-BIT
論文鏈接: https://onlinelibrary.wiley.com/doi/10.1002/advs.202201135

